Il sistema IVUS ad alta definizione ACIST HDi consente una visualizzazione ottimizzata per pianificare la migliore strategia di intervento coronarica e periferica tramite modalità di imaging avanzate, una migliore deliverability del catetere Kodama IVUS e una console interattiva compatta.
Link rapidi
Kodama®
Indicato per le procedure vascolari sia coronariche sia periferiche.
CORONARICA PERIFERICAVedi di più con ACIST HDi
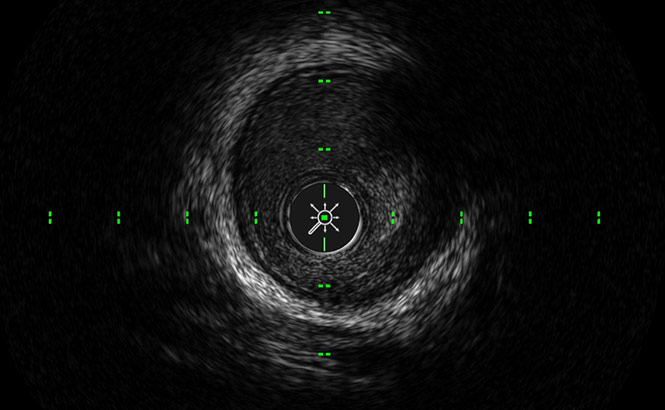
LumenView™
Scurisce il lume coronarico per un migliore rilevamento del bordo.
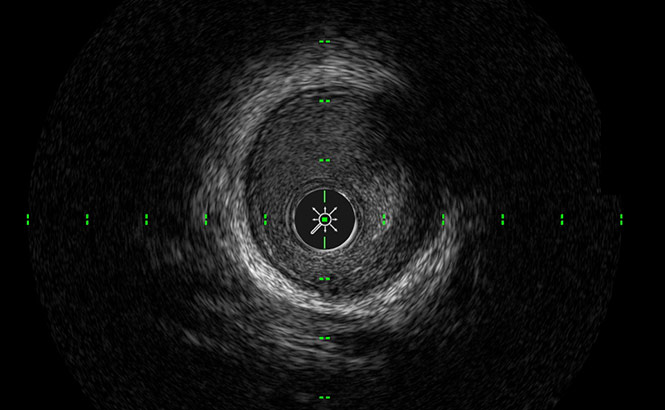
SilkView™
Aumenta la scala di grigi per una migliore differenziazione del sangue circolante, dei tessuti e delle placche.
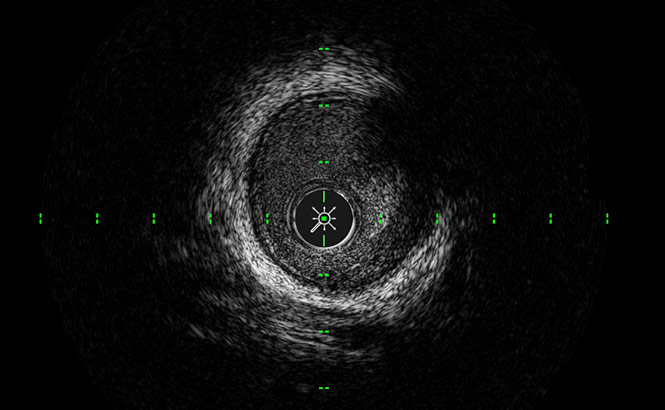
ClassicView™
Ottimizza l’alta risoluzione la profondità di penetrazione consentendo una visualizzazione completa della parete dei vasi.
Evidenza cinica
Migliore visualizzazione della tonaca media rispetto all’OCT per l’ottimizzazione delle dimensioni dello stent4
Ottimizza l’imaging fornendo una penetrazione sufficiente a 60 MHz per visualizzare la tunica media, anche in presenza di grosse placche4, con possibilità di massimizzare l’area della sezione trasversale dello stent e ottenere maggiori informazioni utili nella gestione del paziente5

L’uso del sistema IVUS ha cambiato la strategia di trattamento durante la procedura il 74% delle volte6
Gli stent IVUS-guidati avevano anche un carico di placca prossimale inferiore e distale e una MSA più elevata rispetto al gruppo angio-guidato7

Rilevamento 8 volte superiore dei depositi lipidici a 60 MHz rispetto a 40 MHz8
La PCI IVUS-guidata è vantaggiosa per prevenire la ristenosi intra-stent nei casi con lesioni delle placche diffuse rispetto alla sola angiografia9

L’IVUS è meno costoso è più conveniente dell’angiografia nel 71% delle procedure PCI10
IVUS fornisce esiti migliori a costi inferiori, con un grande vantaggio economico specialmente nei sottogruppi a rischio più alto (diabete, insufficienza renale, ACS)
Risultati basati su una prospettiva di terzo pagante del Servizio Sanitario Italiano10
Guarda la differenza.18
IVUS periferico
Evidenza cinica

L’uso dell’IVUS nelle procedure degli arti inferiori è stato associato a un minore rischio di complicanze post-procedura e un minore rischio di amputazione11

2,8 rivascolarizzazioni della lesione bersaglio in meno al follow-up a un anno quando si utilizzano le procedure di aterectomia direzionale rispetto alla sola angiografia12
Le misurazioni ottenute dalle immagini angiografiche erano costantemente minori in tutti i segmenti arteriosi rispetto a quelle ottenute dalla valutazione IVUS13
69% in più di calcio rilevato con l’IVUS rispetto all’angiografia nelle stesse lesioni14
Doppio di trombi identificati dall’IVUS rispetto all’angiografia15
Quadruplo di dissezioni post-stent sono state identificate con l’IVUS rispetto all’angiografia16
3,5 volte di dissezioni post-angioplastica in più sono state identificate con l’IVUS rispetto all’angiografia17
6 volte di dissezioni post-aterectomia in più sono state identificate con l’IVUS rispetto all’angiografia17
Guarda la differenza.18
Riferimenti bibliografici
- Dati in archivio – TR-07057 – Internal testing
- Dati in archivio – TR-4050 – Study Summary for Kodama catetere performance
- Dati in archivio – TR-07057 – Internal testing
- IVUS-Guided Versus OCT-Guided Coronary Stent Implantation: A Critical Appraisal https://doi.org/10.1016/j.jcmg.2017.09.008
- Defining a new standard for IVUS optimized drug eluding stent implantation: the PRAVIO study. Catheter Cardiovasc Interv. 1° agosto 2009;74(2):348-356. 6. Maehara A, et al – 16 Nov 2018https://doi.org/10.1161/CIRCINTERVENTIONS.117.006243Circulation: Cardiovascular Interventions. 2018;11:e006243
https://www.tctmd.com/news/ultimate-ivus-superior-angiography-guiding-pci-less-tvf-1-year. https://doi.org/10.1016/j.jacc.2018.09.01 8. Tanaka S, - Sakamoto K, Kitahara H, et al. Assessments of lipid plaque and thrombus with a novel high-definition 60-MHz IVUS imaging system: comparison with conventional 40-MHz IVUS and OCT. J Am Coll Cardiol. 2013;62(18_S1):B201-B202 8a. Total of 50 matched cross-sections were analyzed with lipid core identified in 8 cross-sections in an ex-vivo study.
- Impact of the distance from the stent edge to the residual plaque on edge restenosis following DES implantation. PLOS One. 2015;10(3):E0121079. 10.
- Alberti, A., Giudice, P., Gelera, A. et al. Understanding the economic impact of intravascular ultrasound (IVUS). Eur J Health Econ 17, 185–193 (2016). https://doi.org/10.1007/s10198-015-0670-4
- Panaich, S. S., Arora, S., Patel, N., Patel, N. J., Savani, C., Patel, A., … Badheka, A. O. (2016). Intravascular Ultrasound in Lower Extremity Peripheral
- Vascular Interventions: Variation in Utilization and Impact on In-Hospital Outcomes From the Nationwide Inpatient Sample (2006–2011). Journal of Endovascular Therapy, 23(1), 65–75. https://doi.org/10.1177/1526602815620780
- Krishnan, P., Tarricone, A., K-Raman, P., Majeed, F., Kapur, V., Gujja, K., … Sharma, S. (2018). Intravascular ultrasound guided directional atherectomy versus directional atherectomy guided by angiography for the treatment of femoropopliteal in-stent restenosis. Therapeutic advances in cardiovascular disease, 12(1), 17–22. doi:10.1177/1753944717745509
- Pliagas, G., Saab, F., Stavroulakis, K., Bisdas, T., Finton, S., Heaney, C., … Mustapha, J. A. (2020). Intravascular Ultrasound Imaging Versus Digital Subtraction Angiography in Patients With Peripheral Vascular Disease. The Journal of Invasive Cardiology, 32(3), 99–103. Riportato da https://www.invasivecardiology.com/articles/intravascular- ultrasound-imaging-versus-digital-subtraction-angiography-patients-peripheral-vascular-disease?fbclid=IwAR1qh_GQ85jMvJqGpOeYU_So2gaYF7ol5sknbJmoO-GMmB8JjvMd7gscSi0
- Yin D et al. Intravascular Ultrasound validation of contemporary angiographic scores evaluting the severity of calcification in peripheral arteries. J Endovasc Ther 2017; 24:478-87. 15. Shammas et al. Dethrombosis of the lower extremety arteries using the power-pulse spray technique in patients…. J Endovasc Ther 2008;15:570-79. 16. Miki K, Fujii K, Fukunaga M, et al. Impact of post-procedural intravascular ultrasound findings on long-term results following self-expanding nitinol stenting in superficial femoral artery lesions. Circ J 2013; 77:1543-1550. 17. Shammas NW, Torey JT, Shammas WJ, Jones-Miller S, Shammas GA. Intravascular ultrasound assessment and correlation with angiographic findings demonstrating femoropopliteal arterial dissections post atherectomy: results from the iDissection study. J Invasive Cardiol. 2018;30:240–244.
- Krishnan, P., Tarricone, A., K-Raman, P., Majeed, F., Kapur, V., Gujja, K., … Sharma, S. (2018). Intravascular ultrasound guided directional atherectomy versus directional atherectomy guided by angiography for the treatment of femoropopliteal in-stent restenosis. Therapeutic advances in cardiovascular disease, 12(1), 17–22. doi:10.1177/1753944717745509
- Pliagas, G., Saab, F., Stavroulakis, K., Bisdas, T., Finton, S., Heaney, C., … Mustapha, J. A. (2020). Intravascular Ultrasound Imaging Versus Digital Subtraction Angiography in Patients With Peripheral Vascular Disease. The Journal of Invasive Cardiology, 32(3), 99–103. Riportato da https://www.invasivecardiology.com/articles/intravascular-t sound-imaging-versus-digital-subtraction-angiogra phy-patients-peripheral-vascular-disease?fbclid=IwAR1qh_GQ85jMvJqGpOeYU_So2gaYF7ol5sknbJmoO-GMmB8JjvMd7gscSi0
- Yin D et al. Intravascular Ultrasound validation of contemporary angiographic scores evaluting the severity of calcification in peripheral arteries. J Endovasc Ther 2017; 24:478-87.
Shammas et al. Dethrombosis of the lower extremety arteries using the power-pulse spray technique in patients…. J Endovasc Ther 2008;15:570-79.
Miki K, Fujii K, Fukunaga M, et al. Impact of post-procedural intravascular ultrasound findings on long-term results following self-expanding nitinol stenting in superficial femoral artery lesions. Circ J 2013; 77:1543-1550. - Shammas NW, Torey JT, Shammas WJ, Jones-Miller S, Shammas GA. Intravascular ultrasound assessment and correlation with angiographic findings demonstrating femoropopliteal arterial dissections post atherectomy: results from the iDissection study. J Invasive Cardiol. 2018;30:240–244.’ 8. Dati in archivio – TR-07057 – Internal testing. 9. Dati in archivio – TR-4050 – Study Summary for Kodama catetere performance.
- Dati in archivio – TRCO-17355
Prima dell’uso, consultare le istruzioni per l’uso, reperibili all’interno della confezione del prodotto (se disponibili) o su acist.com per informazioni più dettagliate sull’uso sicuro del dispositivo.
Indicazioni per l’uso
Il sistema ACIST HDi® è destinato ad essere utilizzato per l’esame ecografico della patologia intravascolare coronarica e periferica. L’ecografia intravascolare è indicata per i pazienti candidati a interventi transluminali. Il catetere intravascolare per ecografia ACIST Kodama è destinato all’uso con il sistema ACIST HDi.
Controindicazioni
Controindicato per pazienti con: batteriemia o sepsi; spasmo arterioso; importanti anomalie del sistema di coagulazione; valvole cardiache meccaniche che sarebbero attraversate dal catetere; grave instabilità emodinamica o shock; occlusione totale dei vasi (prima delle fasi iniziali della rivascolarizzazione). Controindicato per l’uso nelle arterie cerebrovascolari. Nelle procedure coronariche il prodotto è controindicato anche per i pazienti che sono: non idonei per intervento di rivascolarizzazione; non idonei per angioplastica con palloncino (PTCA).
Informazioni importanti sulla sicurezza
Gli studi ecografici intravascolari che utilizzano questo prodotto devono essere eseguiti solo da medici e altri professionisti medici completamente formati nelle tecniche e procedure richieste. Il catetere Kodama contiene un sistema di innesto su filo guida monorail corto. Di conseguenza, il filo guida potrebbe restare impigliato e/o subire un prolasso durante l’inserimento e il ritiro del catetere. Prima dell’uso e quando possibile durante l’uso, ispezionare attentamente il catetere Kodama per controllare che non ci siano piegature e altri danni. Non usare un catetere piegato o danneggiato in quanto possono verificarsi danni ai vasi e/o impossibilità di fare avanzare o ritrarre il catetere.
Non fare avanzare o ritrarre il catetere Kodama se si avverte una resistenza; determinare la causa di tale resistenza mediante fluoroscopia. Il movimento del catetere o del filo guida in presenza di una resistenza può causare l’allungamento o la separazione della punta del catetere o del filo guida, danni al catetere o perforazione dei vasi.
Quando si fa avanzare il catetere Kodama attraverso un vaso munito di stent, i cateteri con monorail corto sono soggetti a intrappolamento del filo guida/catetere, separazione della punta del catetere e/o dislocazione dello stent.
Gli eventi avversi che possono verificarsi come conseguenza di un’ecografia intravascolare includono, ma non sono limitati a: occlusione vascolare e/o chiusura improvvisa; embolia gassosa; dissezione, lesione o perforazione vascolare; infarto miocardico acuto; aritmie cardiache, incluse ma non limitate a tachicardia ventricolare, fibrillazione ventricolare e blocco cardiaco completo; tamponamento cardiaco; intrappolamento del catetere o del filo guida; ischemia indotta da catetere; morte; trauma vascolare che richiede trattamento/intervento chirurgico, tra cui angioplastica/stent; infezione; danni alla struttura dello stent; ictus (incluso incidente vascolare cerebrale e attacco ischemico transitorio); formazione di trombi e tromboembolie; vasospasmo.